








《影响化学反应速率及影响因素PPT课件下载》是由用户上传到老师板报网,本为文库资料,大小为1.65 MB,总共有37页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 37页
- 1.65 MB
- VIP模板
- ppt
- 数字产品不支持退货
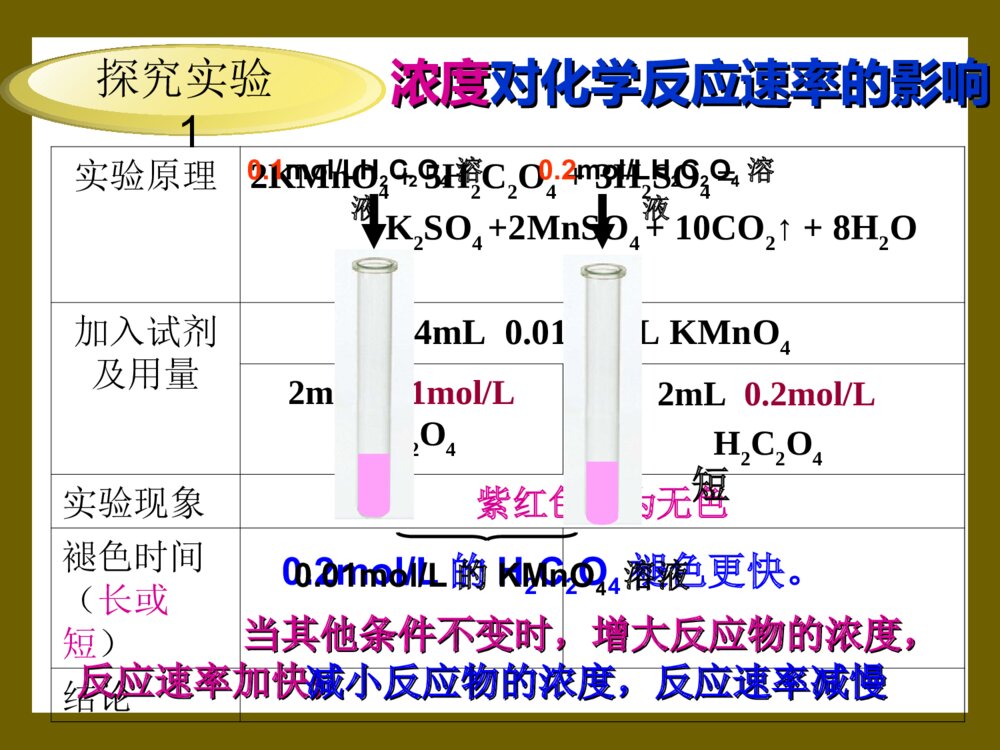
第二节影响化学反应速率的因素杨英杨英铁的生锈烟花的燃放爆炸溶洞的形成[问题]•能够影响化学反应的速率有哪些呢?从前面所谈及的炸药的爆炸、烟花的燃从前面所谈及的炸药的爆炸、烟花的燃放放、、金属的锈蚀、溶洞形成不难看出金属的锈蚀、溶洞形成不难看出影响化学反应的速率的决定因素是什么?一、影响化学反应速率的因素•1、内部因素•在相同外界条件下,_____________是决定化学反应速率的内部因素。反应物的性质是否还有其它一些外部因素能够影响化学反应速率呢?•⑴浓度;•⑵温度;•⑶压强;•⑷催化剂;•⑸其他因素外部因素 科学的实验探究方法•1、对比实验。•2、控制反应条件。•在做对比实验的时候,保持其它条件不变,只能改变其中的一个条件。•3、观察实验现象的方法。•看气泡冒出的速度,溶液颜色的变化,固体质量的变化等。实验原理2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O加入试剂及用量4mL0.01mol/LKMnO42mL0.1mol/LH2C2O42mL0.2mol/LH2C2O4实验现象紫红色变为无色褪色时间(长或短)结论探究实验1浓度浓度对化学反应速率的影响对化学反应速率的影响长短0.2mol/L的H2C2O4褪色更快。当其他条件不变时,增大反应物的浓度,当其他条件不变时,增大反应物的浓度,反应速率加快;反应速率加快;减小反应物的浓度,反应速率减慢减小反应物的浓度,反应速率减慢0.01mol/L的KMnO4溶液0.1mol/LH2C2O4溶液0.2mol/LH2C2O4溶液注意对于纯固体或纯液体,其浓度可视为常数,因而其物质的量改变时不影响化学反应速率。一定量的盐酸跟过量的铁粉反应时,为了减慢反应速率,而不影响生成H2的总量,可向其中加入适量的()A、Na2CO3晶体B、少量铁粉C、水D、少量CuSO4晶体C巩固练习食品袋中加除氧剂你能举出生活中利用改变浓度改变反应速率的例子吗2、压强对反应速率的影响。 对于有气体参加的反应来说,若其他条件不变,增大压强,气体的体积减小。浓度增大。反应速率加快。说明:由于压强对固体和液体的体积几乎无影响,因此对于无气体参加的反应,压强对反应速率的影响可忽略不计。注意:a、压强影响,只适用于讨论有气体参加的反应。 b、压强对速率的影响是通过改变气体的浓度来实现的。即压强变则体积变,实际是浓度的变化。若容器的体积不变,因为各气体的浓度没有变,则速率不变。反应速率无变化!恒容条件下,反应N2+3H22NH3中充入He气,反应速率如何改变?He分子讨论对于压强的改变,只有引起反应体系中反应物浓度的变化,才对反应速率产生影响。改变压强,其实是改变了反应物的浓度。注意!!三、温度对化学反应速率的影响[实验目的]探究温度的不同对化学反应速率的影响[实验原理]Na2S2O3+2HCL=NaCL+SO2+S↓+H2O[实验用品]试管、胶头滴管、0.1mol/L的H2SO4溶液、0.1mol/LNa2S2O3溶液[实验步骤]1.取两支试管各加入10mL0.1mol/L的HCL;另取两支试管各加入10mL0.1mol/LNa2S2O3;2.将四支试管分成两组(各有一支盛有HCL和Na2S2O3的试管),将其中一组浸入到热水中,将另一组试管浸入到冷水中;3.经过一段时间后,分别混合并搅拌,观察现象。探究实验结论:其它条件不变,升高温度,反应速率加快;降低温度,反应速率减慢。编号0.1mol/LNa2S2O30.1mol/LH2SO4反应温度反应快慢12ml2ml冰水22ml2ml热水 3.温度对化学反应速率的影响慢快冰箱延长食物保鲜期你能举出生活中利用改变温度改变反应速率的例子吗4、催化剂对反应速率的影响[学生分组实验]2--4[结论]使用适当的催化剂可以提高反应速率。 5.固体表面积结论:当其它条件不变时,增大接触面积加快化学反应的速率;减少反应物的接触面积,可减慢化学反应的速率。浓度、压强、温度、催化剂等对反应速率影响的本质原因是什么?能否用有效碰撞理论进行解释?知识回顾及知识准备:(1)有效碰撞:能够发生化学反应的碰撞叫做有效碰撞。(2)活化分子:能够发生有效碰撞的分子叫作活化分子。(3)活化能:活化分子比普通分子多出的那部分能量。分子运动相互碰撞分子具有足够的能量活化分子有合适的取向有效碰撞发生化学反应化学反应发生的条件•化学反应速率与单位时间内分子间的有效碰撞次数(有效碰撞频率)有关。浓度对反应速率的影响反应物浓度增大:即单位体积内反应物分子总数数增大单位体积内活化分子数增加有效碰撞次数增多反应速率加快压强对反应速率的影响结论:增大压强,相当于增大反应物浓度,反应速率加快。温度对反应速率的影响升高温度活化分子的百分数增大(分子运动速率加快,碰撞频率增加)有效碰撞次数增多反应速率加快催化剂对化学反应速率的影响原因:改变反应路径,使发生反应所需的活化能降低,使更多的反应物分子成为活化分子,大大增加活化分子百分数,因而使反应速率加快。正催化剂→降低反应的活化能→V↑→n活↑→活%↑n总不变生成物平均能量活化分子具有能量反应物平均能量能量无催化剂活化分子能量反应物平均能量生成物平均能量有催化剂小结:影响化学反应速率的外因影响外因单位体积内有效碰撞次数化学反应速率分子总数活化分子数活化分子百分数增大反应物浓度增大压强升高温度使用催化剂增加增加不变增加加快增加增加不变增加加快不变增加增加增加加快不变增加增加增加加快1.决定化学反应速率的主要因素是()A.反应物的浓度B.反应温度C.使用催化剂D.反应物的性质巩固练习D2.用3克块状大理石与30毫升3mol/L盐酸反应制取CO2气体,若要增大反应速率,可采取的措施是①再加入30毫升3mol/L盐酸②改用30毫升6mol/L盐酸③改用3克粉末状大理石④适当升高温度()A.①②④ B.②③④ C.①③④ D.①②③B3.等质量的铁粉与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能()组别c(HCl)mol/L温度()℃12.03022.55032.02042.530A.3-1-2-4B.4-2-3-1C.2-4-1-3D.2-4-3-1C4应C(s)+H2O(g)=CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是()A.增加C的量B.将容器的体积缩小一半C.保持体积不变,充入N2使体系压强增大D.保持压强不变,充入N2使容器体积变大AC5.下列有关说法正确的是()A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使化学反应速率增大C.升高温度能使化学反应速率增大的主要原因是增加了反应物分子中活化分子的百分数C1、把食物放在冰箱里就能延长保鲜期而不容易变质。2、加酶洗衣粉的去污能力比普通洗衣粉要强得多。3、实验室进行化学反应时,通常把一些固体物质溶于水配成溶液再进行反应。4、向炉膛鼓风,炉子中的火就会越烧越旺。5、木材用来燃烧,劈开来燃烧得比较旺。讨论:温度催化剂反应物状态浓度接触面积 一.影响化学反应速率的因素•1.反应物的性质(决定因素)•2.外因:•a.其他条件不变的情况下,增大浓度可以提高反应速率•b.其他条件不变的情况下增大压强可以加快反应速率.•c.其他条件不变的情况下,提高反应物的温度可以加快反应速率•d.其他条件不变的情况下,加入催化剂,通常可以提高反应速率•e.压强,接触面积,反应物的状态等也有影响•f.某些反应也会受光、超声波、磁场等影响而改变反应速率。本课小结作业•课后习题:1、2。【思考题】:惰性气体对反应速率的影响 (1)如果保持恒温恒容,加入惰性气体后,反应物的浓度,因此对反应速率 (2)如果恒温恒压,加入惰性气体后,反应体系体积,反应物的浓度,因此反应速率会。不变无影响增大减小减小



















